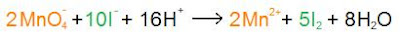Un couple oxydant-réducteur, noté sous la forme oxydant/réducteur, se compose de deux espèces chimiques conjuguées :
- un oxydant, capable de capter des électrons (de subir une réduction)
- un réducteur, capable de donner des électrons (de subir une oxydation).
A chaque couple correspond une demi-équation d'oxydoréduction : Demi-équation d'oxydoréduction du couple Ox/Red.
Demi-équation d'oxydoréduction du couple Ox/Red.
 Demi-équation d'oxydoréduction du couple Ox/Red.
Demi-équation d'oxydoréduction du couple Ox/Red.La réaction d'oxydoréduction consiste en un transfert d'électrons entre deux espèces chimiques appartenant à deux couples différents.
L'oxydant du couple dont le potentiel d'oxydoréduction est le plus élevé réagit avec le réducteur du couple dont le potentiel est le plus faible, selon la règle du gamma :

Équilibre de demi-équations d'oxydoréduction :
1) Équilibrer les atomes autres que O et H.
2) Équilibrer les atomes d'oxygène O avec H2O.
3) Équilibrer les atomes d'hydrogène H avec H+ (en milieu acide).
4) Équilibrer les charges avec des électrons e-.
Exemple 1 : demi-équation du couple Cu2+/Cu

1) OK (1 atome de cuivre Cu de chaque côté)
2) OK (pas d'atome d'oxygène O)
3) OK (pas d'atome d'hydrogène H)
4) Équilibre des charges :

Exemple 2 : demi-équation du couple BrO3-/Br2

1) Équilibre des atomes de brome Br :

2) Équilibre des atomes d'oxygène O avec H2O :

3) Équilibre des atomes d'hydrogène H avec H+ :

4) Équilibre des charges avec des électrons e- :

Équation-bilan d'une réaction d'oxydoréduction :
1) Identifier les réactifs selon la règle du gamma.
2) Écrire les demi-équations correspondant aux deux couples intervenant dans la réaction.
3) Équilibrer le nombre d'électrons donnés et d'électrons captés.
4) Ajouter terme à terme, puis simplifier s'il y a lieu.
Exemple : réaction entre le couple MnO4-/Mn2+ (E0 = 1,51 V) et le couple I2/I- (E0 = 0,62 V)
1) Identifier les réactifs :

2) Écrire les demi-équations :

3) Équilibrer le nombre d'électrons transférés :

4) Bilan :